آموزش مدل سازی الکتروشیمی با باتری نارنجی
آیا معلم شیمی شما در گذشته از پرتقال یا لیمو برای نشان دادن مفهوم باتری استفاده می کرد؟ شاید به یاد داشته باشید که چگونه او با چسباندن چند میخ فلزی به میوه مرکبات، در حالی که تمام کلاس با هیبت تماشا می کردند، چگونه برق تولید می کرد. اگر اکنون از ابزارهای شبیه سازی برای نشان دادن نحوه عملکرد یک باتری نارنجی استفاده کنیم و سپس از آن به عنوان مقدمه ای برای مدل سازی الکتروشیمی استفاده کنیم، چه می شود؟
هندسه باتری ساخته شده از پرتقال.
باتری نارنجی چگونه کار می کند
بدیهی است که این جادو نیست که باتری های نارنجی را قادر می سازد الکتریسیته تولید کنند – این الکتروشیمی است. یک مرکبات، پرتقال حاوی اسید سیتریک است که همراه با یون های دیگر، به عنوان یک الکترولیت عمل می کند. اسید سیتریک به صورت الکتروشیمیایی با دو میخ فلزی واکنش نشان می دهد که باید از فلزات متفاوتی باشند تا هم آزاد شوند و هم الکترون به دست آورند. مدار باید با اجازه دادن به دو میخ برای اتصال الکتریکی از طریق یک هادی فلزی، مانند یک لامپ کوچک (بخشی از فاکتور wow در آزمایشگاه مدرسه) تکمیل شود. در این فرآیند، ناخنهای ما به عنوان الکترود عمل میکنند و یک پتانسیل گالوانیکی روی سلول باتری (در این مورد نارنجی) وجود دارد که انتقال الکترون را تشویق میکند. از آنجایی که ما از واکنش های شیمیایی برای تبدیل انرژی شیمیایی به انرژی الکتریکی استفاده می کنیم، می توانیم باتری نارنجی را نیز به عنوان یکباتری ولتایی ، درست مانند هر باتری دیگری که در آن انرژی در مواد شیمیایی موجود در آن ذخیره شده است.
گالوانی و قورباغه اولین باتری را تولید کردند
واقعیت جالب: یک فیزیکدان ایتالیایی، لوئیجی گالوانی، “الکتریسیته حیوانی” را کشف کرد – وقتی دو فلز مختلف را به صورت متوالی در پای یک قورباغه به هم متصل کرد، شروع به انقباض کرد که در واقع ناشی از حرکت یونها بود. یکی دیگر از فیزیکدانان ایتالیایی به نام الساندرو ولتا که مجذوب این موضوع شده بود، آزمایشات خود را انجام داد و به این نتیجه رسید که پای قورباغه به طور همزمان یک رسانا و یک آشکارساز الکتریسیته است. با تکیه بر این تحقیقات، او سرانجام به چیزی رسید که ما آن را قانون ولتا سری الکتروشیمیایی مینامیم و بعداً در دهه 1800، به اولین باتری رسید.
الکتروشیمی مدلسازی، نمونه باتری نارنجی
اگر در مدل سازی برنامه های الکتروشیمی تازه کار هستید، ممکن است بخواهید با آموزش مدل باتری نارنجی ما شروع کنید . اگر دستورالعمل های گام به گام در PDF را دنبال کنیم، می توانیم جریان ها و غلظت یون های فلزی محلول در باتری نارنجی را مدل سازی کنیم.
یکی از ناخن های ما از روی و دیگری مس است. میخ روی در واکنش الکترود الکترون ها را از دست می دهد به این ترتیب:
Zn( s ) → Zn 2+ 2e – E 0 = -0.82 V
به طوری که یون های روی سپس به الکترولیت در باتری بپیوندند. در همین حال، میخ مسی به عنوان یک الکتروکاتالیست عمل می کند تا واکنش تکامل هیدروژن زیر را از یون های هیدروژن موجود در اسید سیتریک تشویق کند:
2H + + 2e – → H 2 ( g ) E 0 = 0 V
رابط توزیع جریان ثانویه برای تنظیم مدل برای جریان های نارنجی و الکترودها استفاده می شود. توزیع جریان ثانویه فرض میکند که الکتریسیته فقط به صورت مهاجرت یونی از طریق الکترولیت حرکت میکند ، در حالی که واکنشهای الکترودها تابعی از پتانسیل الکتریکی و غلظت محلی گونههای واکنشدهنده هستند. بنابراین قانون اهم، همراه با تعادل بار، برای حل جریان های الکتریکی در میخ ها و الکترولیت پرتقال، که با عبارات باتلر-ولمر که واکنش های الکتروشیمیایی را توصیف می کنند نیز همراه هستند، اعمال می شود. در این مثال، یکی از میخ های ما روی پتانسیل سلولی 0.5 ولت تنظیم شده است، در حالی که دیگری زمین شده است و توزیع جریان محاسبه می شود.
پس از تنظیم و حل مدل، می توانیم عملکرد باتری نارنجی را ارزیابی کنیم.
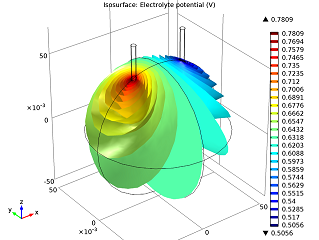 | 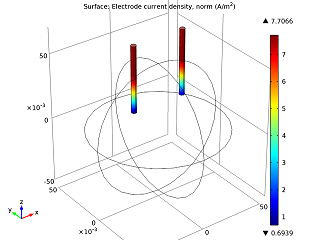 |
| میدان پتانسیل الکترولیت | جریان الکتریکی ناخن ها |
همانطور که در تصویر بالا به سمت چپ می بینیم، با عبور جریان از الکترود روی (میخ سمت چپ) به الکترود مسی (میخ سمت راست)، پتانسیل الکتریکی کاهش می یابد. افت ولتاژ سلول عمدتاً به دلیل تلفات اهمی در الکترولیت است. اگر میخواهیم باتری با عملکرد بهتری داشته باشیم، میتوانیم پرتقال را با میوهای با رسانایی بالاتر (یعنی محتوای اسید بیشتر)، مانند لیمو، عوض کنیم. از طرف دیگر، میتوانیم ناخنها را به هم نزدیکتر کنیم. در مدل بالا به سمت راست می بینیم که جریان الکتریکی در امتداد محور z افزایش می یابد. این اتفاق زمانی رخ میدهد که نوک الکترودها به حجم بیشتری از نارنجی و در نتیجه گونههای واکنشدهندهتر دسترسی دارند تا بتوانند الکترونهای خود را راحتتر به دست آورند و از دست بدهند.
همچنین میتوانیم سطح غلظت یون را پس از مدتی کارکردن باتری مطالعه کنیم و میتوانیم نحوه تغییر جریان سلول در طول زمان را تجسم کنیم. همانطور که یون های روی ساخته می شوند، توانایی واکنش آند را مختل می کنند، بنابراین جریان باتری کاهش می یابد تا زمانی که به چگالی جریان ثابت برسد.
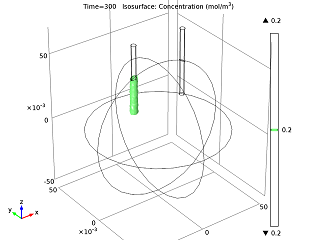 | 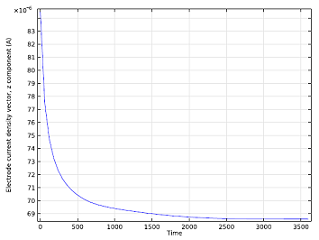 |
| سطح غلظت 0.2 mol/m 3 یون روی را پس از کارکردن باتری به مدت 5 دقیقه، ایزوسورفیس کنید . |
- لینک دانلود به صورت پارت های 1 گیگابایتی در فایل های ZIP ارائه شده است.
- در صورتی که به هر دلیل موفق به دانلود فایل مورد نظر نشدید به ما اطلاع دهید.
برای مشاهده لینک دانلود لطفا وارد حساب کاربری خود شوید!
وارد شویدپسورد فایل : پسورد ندارد گزارش خرابی لینک

دیدگاهتان را بنویسید